 27.05.2014
27.05.2014 Предприятие «Ледум» предлагает Вашему вниманию продукцию компании C.D.Rich, Китай - вакуумные системы забора крови.
Вакуумная система для забора крови - комплект принадлежностей для забора и хранения венозной крови в целях клинической лабораторной диагностики.
Вакуумная система состоит из трёх компонентов (рис.1):
1. Вакуумная пробирка.
2. Игла для венопункции.
3. Держатель иглы с пробиркой.
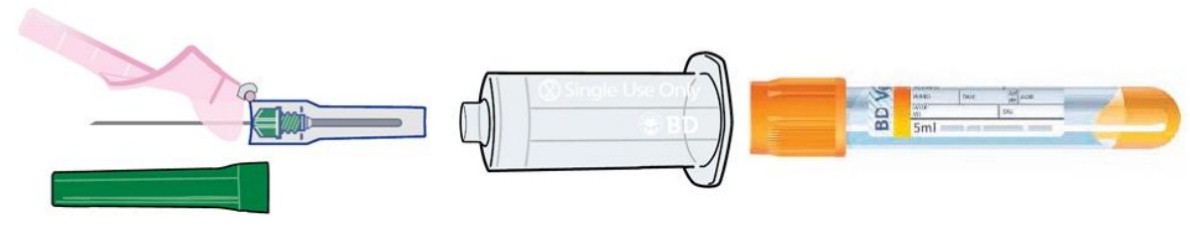
Рис. 1. Вакуумная система для взятия крови
Преимущества перед открытыми пробирками:
- Обеспечение гарантий безопасности пациента за счет стерильности и замкнутости системы.
- Сокращение числа преаналитических ошибок благодаря фиксированному объёму забранной крови и соответствующих добавок, а также за счет вышеупонянутой замкнутости системы.
- Конструкция элементов системы снижает вероятность попадания крови на персонал и окружающие поверхности во время венопункции.
- Обеспечение системой стерильности процедуры венопункции.
- Добавки продлевают время хранения материала.
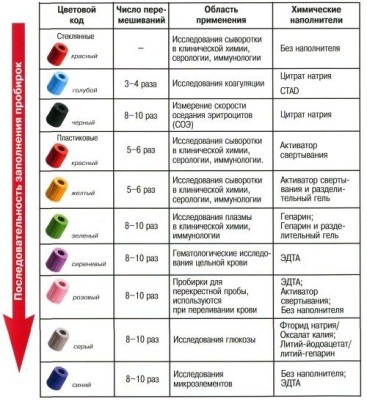
Пластиковые вакуумные пробирки для взятия крови
Стандартные пробирки изготовлены из ПЭТ (полиэтилентерефталат). Внутренняя поверхность пробирок покрыта силиконом (снижает адгезию клеток крови к поверхности стенок пробирки). Пробирки, благодаря наличию в них вакуума, обеспечивают наполнение заданного объёма крови (от 1,6 до 9,0 мл). В соответствии с условиями аналитических методик предлагаются пробирки с добавками реагентов (сухие кристаллы кремнезёма, литий или натрий гепарин, цитрат натрия 3,8% и др.).
Внутренние поверхности и наполнители пробирок проходят стерилизацию гамма-излучением.
Герметичность пробирок достигается за счет применения системы SCA–резиновой пробки (бромбутилкаучук), покрытой гемоотталкивающим репеллентом, и пластиковой крышки (полиэтилен) с вертикальными бороздками.
Сегодня целесообразность вакуумных закрытых систем для взятия крови (рис.1) уже не подвергается сомнению. Использование качественных систем позволяет не только стандартизировать методики и получаемые результаты, но и максимально обезопасить медицинский персонал от инфицирования, поскольку при этом снижается количество контактов медицинских работников с кровью пациента и вероятность уколоться использованной иглой.
Несмотря на кажущуюся большую стоимость вакуумных систем по сравнению с обычными стеклянными пробирками, экономически это современное решение оказывается более выгодным для ЛПУ:
- во-первых, значительно снижается количество испорченных образцов и преаналитических ошибок, что уменьшает число повторных исследований, частоту поломок оборудования (забитые микросгустками дозирующие иглы и т.п.);
- во-вторых, ускоряется процесс взятия и обработки крови. Все производители автоматизированного лабораторного оборудования рекомендуют использовать такие закрытые вакуумные системы.
Одним из самых часто встречающихся следствий неправильного взятия крови (в частности, при использовании неправильных игл, отборе крови в обычные шприцы, при слишком интенсивном перемешивание после взятия крови) является гемолиз. Проблемы с гемолизом часто возникают при экстренных ситуациях, когда взятие крови не может быть осуществлено обычным образом, то есть из вены в вакуумную пробирку. В случае использования для забора крови внутривенного катетера или шприца с последующим переносом в пробирку увеличивается количество гемолизированных образцов (по сравнению с первичным забором в вакуумную пробирку).
В случае взятия образцов в несколько пробирок за один раз, важно соблюдать последовательность заполнения пробирок (рис. 2), рекомендуемую их производителем, поскольку при смене пробирок возможна контаминация адаптера добавкой из предыдущей пробирки. Первыми заполняют пробирки для получения сыворотки, не содержащие никаких добавок; после них - пробирки с активатором свертывания; следом за ними - пробирки для плазмы, поскольку попадание в пробирки для сыворотки ЭДТА или гепарина может приводить к снижению скорости формирования сгустка.
Важно также тщательно, но аккуратно, перемешивать пробирки (рис. 3) после взятия крови для равномерного распределения антикоагулянта или активатора свертывания по всему объёму, а также соблюдать установленный производителем объём крови при заполнении пробирок. Если вовремя не перемешивать пробирку с антикоагулянтом, в объёме, куда гепарин ещё не диффундировал, могут начать формироваться микросгустки, влияющие на последующий анализ. В случае заметного отличия объёма отобранной крови от рекомендуемой, не достигается требуемая концентрация антикоагулянта или активатора свёртывания, что может также сказываться на результате анализов. Поэтому важно соблюдать не только последовательность взятия крови, но также выполнять рекомендации производителя систем по объёму крови и количеству перемешиваний.
Рис. 2. Порядок взятия крови в пробирки
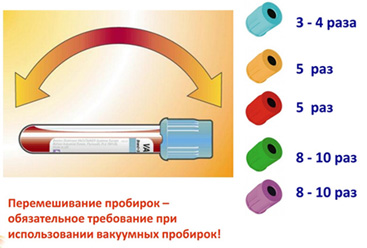
В то же время, перемешивание не должно быть излишне интенсивным, поскольку это негативно сказывается на конечном состоянии образца (рис. 4). На рисунке можно видеть пробирки, с которыми неправильно обращались при заборе крови. При неправильном перемешивании или его отсутствии, формирование сгустка в пробирках с активатором свертывания или без добавок может проходить неравномерно. Если пробирка после взятия крови сразу положена горизонтально, а не поставлена после перемешивания в штатив, то могут формироваться лентовидные сгустки, в результате неполного образования сгустка в сыворотке остается фибрин. В пробирках с антикоагулянтами в случае неправильного перемешивания антикоагулянт распределяется неравномерно, что может приводить к локальному формированию сгустков. Негативно сказывается на образцах и чрезмерно интенсивное перемешивание или встряхивание, приводящее к формированию пены и гемолизу. Перемешивать пробирки следует мягкими переворачиваниями пробирки рекомендованное число раз. В результате наполнитель равномерно распределяется по объёму взятой крови, в то же время не повреждаются клетки и сложные биологические вещества (ферменты, белки), содержащиеся в ней.
Рис. 3.
 Помимо этого, очень важное значение играет выбор наполнителя пробирки, антикоагулянта или активатора свёртывания. Разные типы антикоагулянтов применяются для разных типов анализов в силу того, что эти вещества могут вступать во взаимодействие с компонентами анализируемых образцов или иначе влиять на результат. Так, для гематологических анализов лучше всего подходит К2ЭДТА, для исследования коагуляции - цитрат натрия и т. п. Причины этих связей пока не выяснены. К примеру, фторид натрия, применяемый в консервировании крови, при определении глюкозы, блокирует активность утилизирующих сахар ферментов и сохраняет его исходное количество. Но по той же причине (ингибирование ферментов), плазму из этих пробирок нельзя применять для определения активности АлАТ, АсАТ и прочих ферментов. Фторид натрия и соль ЭДТА калия связывают Са2+, заменяя в крови 1 ион кальция на 2 иона калия. При этом повышается ионная сила раствора, в результате чего происходит «выкачивание» воды из внутриклеточного пространства в межклеточное, сморщивание клеток крови с умеренным высвобождением из эритроцитов гемоглобина. Поэтому образцам крови с такой добавкой часто свойственен видимый гемолиз. Глюкоза превращается в лактат в результате нескольких превращений. Фторид ингибирует одно из таких превращений. В то же время начальные этапы превращений с участием гексокиназы и фосфофруктокиназы блокируются менее эффективно, поэтому на практике наблюдается снижение содержания глюкозы в образце крови на 6–7% от первоначального. После первоначального незначительного снижения уровня глюкозы, её количество остается постоянным при хранении крови в пробирке в течение 8–10 часов при температуре до +25°С, и в течение 2–3 дней в холодильнике ( +4°С).
Помимо этого, очень важное значение играет выбор наполнителя пробирки, антикоагулянта или активатора свёртывания. Разные типы антикоагулянтов применяются для разных типов анализов в силу того, что эти вещества могут вступать во взаимодействие с компонентами анализируемых образцов или иначе влиять на результат. Так, для гематологических анализов лучше всего подходит К2ЭДТА, для исследования коагуляции - цитрат натрия и т. п. Причины этих связей пока не выяснены. К примеру, фторид натрия, применяемый в консервировании крови, при определении глюкозы, блокирует активность утилизирующих сахар ферментов и сохраняет его исходное количество. Но по той же причине (ингибирование ферментов), плазму из этих пробирок нельзя применять для определения активности АлАТ, АсАТ и прочих ферментов. Фторид натрия и соль ЭДТА калия связывают Са2+, заменяя в крови 1 ион кальция на 2 иона калия. При этом повышается ионная сила раствора, в результате чего происходит «выкачивание» воды из внутриклеточного пространства в межклеточное, сморщивание клеток крови с умеренным высвобождением из эритроцитов гемоглобина. Поэтому образцам крови с такой добавкой часто свойственен видимый гемолиз. Глюкоза превращается в лактат в результате нескольких превращений. Фторид ингибирует одно из таких превращений. В то же время начальные этапы превращений с участием гексокиназы и фосфофруктокиназы блокируются менее эффективно, поэтому на практике наблюдается снижение содержания глюкозы в образце крови на 6–7% от первоначального. После первоначального незначительного снижения уровня глюкозы, её количество остается постоянным при хранении крови в пробирке в течение 8–10 часов при температуре до +25°С, и в течение 2–3 дней в холодильнике ( +4°С).
Рис. 4. Результаты ошибок при взятии крови
С учетом особенностей взаимодействия компонентов анализируемого образца с различными добавками, для каждого теста следует сверяться с инструкцией, чтобы уточнить, какой образец рекомендует использовать производитель данных реагентов.
Для более чистого разграничения жидкой фракции крови и сгустка при центрифугировании применяются специальные пробирки, содержащие инертный гель (рис. 5).
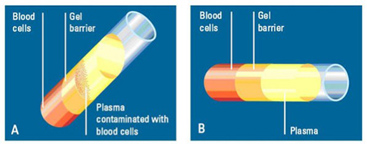 Этот гель тяжелее плазмы, но легче форменных клеток крови, поэтому после центрифугирования образцов он образует слой, служащий разделительным барьером. Хотя гель химически и биологически инертен, однако, он может оказывать влияние на результаты ряда тестов. Так, было замечено, что при использовании некоторых пробирок с гелем могут несколько искажаться результаты тестов, в частности, гормональных.
Этот гель тяжелее плазмы, но легче форменных клеток крови, поэтому после центрифугирования образцов он образует слой, служащий разделительным барьером. Хотя гель химически и биологически инертен, однако, он может оказывать влияние на результаты ряда тестов. Так, было замечено, что при использовании некоторых пробирок с гелем могут несколько искажаться результаты тестов, в частности, гормональных.
Для большинства иммунохимических тестов рекомендуется использовать сыворотку, то есть кровь забирается в пробирки без добавок или с активаторами коагуляции.
Рис. 5. Различия в положении геля и осадка при центрифугировании в угловом (А) и горизонтальном (В) роторах
Обработка образцов
Пробирки для сыворотки перед центрифугированием следует выдерживать не менее указанного производителем пробирок времени до формирования сгустка надлежащего качества. Многие рекомендации советуют выдерживать пробирки для получения сыворотки 60 минут и 30 минут - пробирки с гелевым барьером.
Желая получить результаты побыстрее, некоторые лаборатории выдерживают пробирки недостаточное время, что повышает вероятность образования фибриновых нитей уже после центрифугирования и отделения сыворотки, что может сказаться на результатах, особенно в случаях, если у пациента понижена свертываемость.
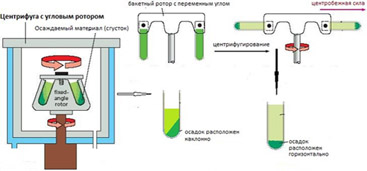 Правильное центрифугирование также важно для того, чтобы из сыворотки были удалены все сгустки и нити фибрина. Кроме того, гелевый барьер в первичных пробирках, обрабатываемых автоматическими анализатором, после центрифугирования должен располагаться горизонтально, для чего следует использовать центрифуги с бакетными, а не угловыми роторами (рис. 6– 8). В результате применения угловых роторов (с фиксированным углом наклона пробирок) образуется сгусток неправильной формы и скошенный гелевый барьер, который при приведении пробирки в вертикальное положение стремится стать горизонтальным, при этом часть фибрина может всплыть. Кроме того, в случае небольшого количества сыворотки затруднен её отбор иглой дозатора (так называемые ошибки уровня образца на приборах).
Правильное центрифугирование также важно для того, чтобы из сыворотки были удалены все сгустки и нити фибрина. Кроме того, гелевый барьер в первичных пробирках, обрабатываемых автоматическими анализатором, после центрифугирования должен располагаться горизонтально, для чего следует использовать центрифуги с бакетными, а не угловыми роторами (рис. 6– 8). В результате применения угловых роторов (с фиксированным углом наклона пробирок) образуется сгусток неправильной формы и скошенный гелевый барьер, который при приведении пробирки в вертикальное положение стремится стать горизонтальным, при этом часть фибрина может всплыть. Кроме того, в случае небольшого количества сыворотки затруднен её отбор иглой дозатора (так называемые ошибки уровня образца на приборах).
При центрифугировании убедитесь, что пробирки вставлены в ротор таким образом, что крышка (пробка) не опирается на стенки стакана центрифуги, иначе крышка может соскочить с пробирки.
Рис. 6. Схема формирования осадка при использовании центрифуг с угловым (А) и горизонтальным (В) роторами
В центрифугах с горизонтальными откидывающимися стаканами образуется более стабильный гелевый барьер, чем в центрифугах с фиксированным углом наклона. Высокие температуры могут оказывать отрицательное воздействие на физические свойства геля. Наиболее полное отделение плазмы происходит при температуре 20°С - 22°С.

Для расчета ОЦС используется следующая формула (рис. 9):
ОЦС = 11,18 х r x (rpm )2 / 1000
где rmp – скорость вращения ротора (обороты в минуту), а r – радиус (см).
Примечание: радиус измеряется от центра вращения до дна пробирки при её максимально удаленном расположении.
Внимание!
- Запрещается транспортировка пробирок с гелем без предварительного центрифугирования!
- Резкие движения могут вызвать разрушение геля и попадание его частиц в пробу, что приведет к ошибочным результатам анализа.
- Пробирки с гелем необходимо центрифугировать не позднее 2 часов после взятия крови. Длительный контакт клеток крови с плазмой может привести к ошибочным результатам анализа. Когда гелевый барьер уже сформировался, пробирки не следует центрифугировать повторно.
- Повторное центрифугирование пробирок может привести к разрушению гелевого барьера и попаданию частиц геля в плазму.
Рис. 7. Бакетный ротор (горизонтальный) – с изменяющимся при центрифугировании углом наклона пробирок.
- Не используйте эритроциты, которые находятся под гелевым барьером для проведения изосерологических проб.
- Не снимайте крышку с пробирки перед центрифугированием — это может привести к попаданию потенциально инфицированного материала на оборудование и обслуживающий персонал.

Помимо правильного взятия крови и центрифугирования также важно соблюдать сроки хранения образцов и температурный режим для предотвращения распада аналитов и порчи образца от других причин, таких как замораживание, перегрев, интенсивное перемешивание и прочее.
Если образцы поступают из удаленной лаборатории, то рекомендуется центрифугировать их повторно, непосредственно перед проведением анализа, поскольку при перевозке могло происходить взбалтывание и переход части фибрина и других нежелательных компонентов обратно в сыворотку. Это также позволит осадить нити фибрина, которые могли образоваться в сыворотке уже после обработки образца.
Рис. 8. Угловой ротор с фиксированным углом наклона пробирок

Пробирки вакуумные без наполнителя, цвет крышки - красный
- Предназначены для получения нативной крови, для хранения плазмы, сыворотки, цереброспинальной жидкости и других биологических жидкостей организма (моча, плевральная жидкость, перитонеальный выпот).
- Пробирки без наполнителя не предназначены для получения сыворотки, т.к. без активатора сгустка, время свертывания крови 1–1,5 часа.
- Применение: гематология, хранение биоматериала.
- Материал для исследования: цельная кровь.
- Действия: 5–8 раз аккуратно переверните непосредственно после взятия крови, центрифугируйте через полчаса.
- Параметр центрифугирования: 2000g / 5 мин.

Пробирки вакуумные с активатором свёртывания крови, цвет крышки - оранжевый
- Предназначены для получения сыворотки, стенки пробирок покрыты сухим активатором образования сгустка (SiO2) для ускорения свёртывания крови. Смешивание крови с ним не влияет на результаты анализов. Ускорение процесса свёртывания крови существенно сокращает время подготовки биологической пробы.
- Время свертывания крови 10–30 мин.
- Применение: клиническая химия, иммунология.
- Материал для исследования: сыворотка.
- Действия: 5–8 раз аккуратно переверните непосредственно после взятия крови, центрифугируйте через полчаса.
- Параметр центрифугирования: 2000g / 5 мин.

Пробирки вакуумные с активатором свёртывания крови и разделительным гелем, цвет крышки - желтый
- Предназначены для получения сыворотки. Инертный гель находится на дне пробирки. Масса этого вещества меньше массы кровяного сгустка и больше массы сыворотки. Во время центрифугирования гель поднимается вверх и формирует стабильный барьер, отделяющий сыворотку от фибрина и форменных элементов крови. Гель обеспечивает разделение сыворотки и сгустка до 48 часов без повторного центрифугирования. Пробирки с гелем необходимо центрифугировать не позднее, чем через 2 часа после взятия крови.
- Применение: клиническая химия, иммунология.
- Материал для исследования: сыворотка.
- Действия: 5–8 раз аккуратно переверните непосредственно после взятия крови, центрифугируйте через полчаса.
- Параметр центрифугирования: 2000g / 5 мин.

Пробирки вакуумные с гепарином, цвет крышки - зеленый
- Предназначены для исследования плазмы, гепаринизированной крови, используются для подсчета клеток крови. При смешивании с забранным материалом гепарин блокирует активность тромбина и тормозит переход растворимого фибриногена в нерастворимый фибрин, блокируя таким образом каскад свертывания крови. Последующее центрифугирование успешно разделяет кровь на плазму и форменные элементы.
- Пробирки содержат 12–30 МЕ сухого гепарина на 1 мл крови.
- Применение: клиническая химия, иммунология, гематология.
- Материал для исследования: плазма.
- Наполнители: литий гепарин, натрий гепарин.
- Действия: 5–8 раз аккуратно переверните непосредственно после взятия крови, убедитесь в адекватности антакоагуляции.
- Параметр центрифугирования: 2000g / 5 мин.

Пробирки вакуумные с цитратом натрия, цвет крышки - голубой
- Предназначены для исследования цитратной плазмы, для исследования коагуляции, содержат буферный раствор тринатриевого цитрата, который является антикоагулянтом в концентрации от 0,100 до 0,136 моль/л. Наиболее часто используют 0,109 моль/л (3,2%) или 0,129 моль/л (3,8%), соотношение цитрата к количеству забираемой крови 1:9, рН крови остается в пределах 7,1–7,35 (важно для протромбиновых параметров).
- Применение: исследование коагуляции.
- Материал для исследования: кровь, цитратная плазма.
- Наполнитель: 3,8% цитрат натрия (0,129 моль/л), 3,2% цитрат натрия (0,109 моль/л)
- Действия : 5–8 раз аккуратно переверните непосредственно после взятия крови, убедитесь в адекватности антикоагуляции.
- Параметр центрифугирования: 2000g / 10 мин.

Пробирки вакуумные с ЭДТА, цвет крышки - сиреневый (фиолетовый)
- Предназначены для гематологических исследований, содержат ЭДТА (калиевая соль этилендиаминтетрауксусной кислоты), которая предотвращает свертывание крови путем блокирования ионов кальция. ЭДТА не влияет на гематологические параметры.
- Сухая К2ЭДТА или жидкая К3ЭДТА в пробирке с концентрацией 1,2–2,0 мг (0,00411 моль/л–0,006843 моль/л) сухой соли ЭДТА на 1 мл крови.
- Пробирки с ЭДТА можно применять при анализе крови с использованием автоматических гематологических анализаторов, не открывая пробирки. Пробозаборник анализатора легко протыкает резиновую часть пробки пробирки.
- В образцах с ЭДТА эритроциты, лейкоциты и тромбоциты остаются стабильными до 24 часов. Мазки крови необходимо делать в течение 3 часов после взятия пробы.
- Действия: 5–8 раз аккуратно переверните непосредственно после взятия крови, убедитесь в адекватности антикоагуляции.
- Материал для исследования: ЭДТА - кровь, плазма.
- Наполнитель:К2ЭДТА, К3ЭДТА.
- Действия: 5–8 раз аккуратно переверните непосредственно после взятия крови, убедитесь в адекватности антикоагуляции.
- Параметр центрифугирования: не требует центрифугирования.

Пробирки вакуумные с фторидом натрия + оксалаты для исследования уровня глюкозы, цвет крышки - серый
- Предназначены для исследования уровня глюкозы в крови и содержат антикоагулянт калия оксалат и натрия фторид - стабилизатор глюкозы, благодаря использованию стабилизатора и специальной обработке внутренней поверхности, образец крови может быть сохранен длительное время без изменения своего первоначального состояния.
- Материал для исследования: оксалатная кровь, плазма.
- Наполнитель: фторид натрия / оксалат калия.
- Действия: 5–8 раз аккуратно переверните непосредственно после взятия крови, убедитесь в адекватности антикоагуляции.
- Параметр центрифугирования: не требует центрифугирования.

Пробирки вакуумные с цитратом натрия для определения СОЭ, цвет крышки - чёрный
- Предназначены для исследования СОЭ, содержат буферный раствор цитрата натрия, который является антикоагулянтом. Наиболее часто используются пробирки с 3,8% раствором цитрата натрия (90,129 моль/л). соотношение цитрата к количеству забираемой крови 1:4.
- Применение: измерение скорости оседания эритроцитов,по методу Вестергрена закрытым способом.
- Материал для исследования: цитратная кровь.
- Наполнитель: 3,8% цитрат натрия (0,129 моль/л).
- Действия: 5–8 раз аккуратно переверните непосредственно после взятия крови, убедитесь в адекватности антикоагуляции.
- Параметр центрифугирования: не требует центрифугирования.
Предприятие «ЛЕДУМ» благодарит всех наших потребителей за сотрудничество, за Вашу поддержку во всех наших начинаниях - это дает нам возможность для дальнейшего развития и лучшего обслуживания потребителей, мы очень ценим и принимаем во внимание Ваши комментарии и предложения.
г. Киев, 23-24 апреля 2014 г.
Докладчик врач–лаборант ООО «Ледум» Дедушева И. Г.
При использовании данного материала просим ссылаться на источник и автора информации.
